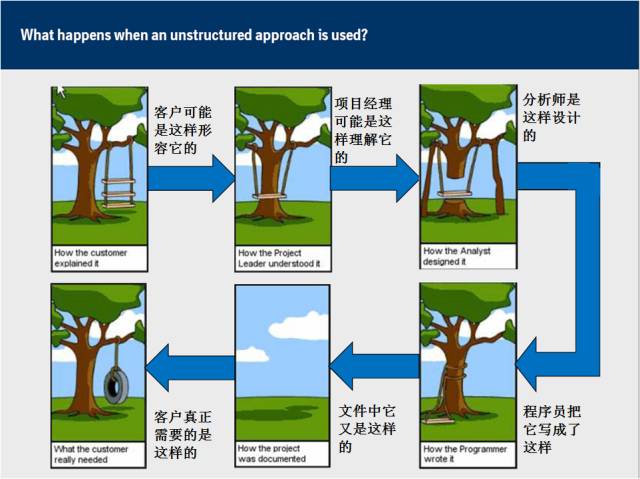
一个管理不善的项目可能是这样的:
因此,引进一台设备/系统或者新建厂房时URSFSDSFATSATDQIQOQPQ之间是环环相扣的。然而这些制药行业常见的术语很多人并不清楚。本文将对这些术语的含义、关系以及引进一个设备时它们的顺序进行阐述。
URS(User requirement specifications)
用户需求规范
Manufacturers should prepare a document that describes, for example, the utility or equipment to be sourced. The requirements and specifications for the utility or equipment should be defined by the user and documented in the URS.
生产者应该准备一个文件描述,如需要采购的设施或设备。设施或设备的需求和规范应该被用户定义并写入在URS文件中。
The URS should be used when selecting the required utility or equipment from an approved supplier, and to verify suitability throughout the subsequent stages of qualification.
URS应该在从批准的供应商中选择设施或设备时被使用,并在随后的确认的各个阶段用于证实适用性。
FAT和SAT(Factory acceptance test and site acceptance test)
工厂验收测试和现场验收测试
Where appropriate, FAT and SAT should be performed to verify the suitability of the system at site, prior to the subsequent stages of qualification. This should be appropriately documented.
在适当情况下,在随后的确认阶段之前,FAT和SAT应该被执行来证实系统在现场的适用性。这应该被适当的记录。
(FAT,Factory acceptance test ,这个名称原来并非一个GMP的名词,而是GEP的概念,但是在新的欧盟GMP附录15和修订的WHO GMP 验证指南中,已经增加了这个内容,现在是GMP的要求了,这也算是质量向前延伸吧。工厂验收测试,顾名思义,在工厂验收时做的测试,这个工厂,并非是使用者,而是设备制造商。为什么需要做这个测试呢?很简单,因为有些项目,在设备制造后,你是无法再对其进行测试的,但是如果到公司了,你才发现不合格,可能就晚了,比如说,反应罐,你到公司了,才发现容量不对,你要再换一个,浪费人力物力。所以需要你在设备出厂前,就在工厂进行测试,确保设备到工厂前,就是合格的。FAT的方案一般会有设备厂家提供,使用方审核,如果使用方也可以根据自己的要求,起草方案,供应商确认。FAT的内容会和IOQ有些重复,两者之间是否能够代替,各有各的说法,我个人认为如果有些项目,FAT中做了测试,www.58yuanyou.com而运输过程对这些又不会产生影响,在IQ中,是可以引用FAT的内容,而不需要进行重复测试,如软件的计算功能。
SAT,Site Acceptance Testing,现场验收测试,同样,这个名词最初是GEP中的概念,在新的欧盟GMP附录15和修订的WHO GMP 验证指南中,也增加了这个内容。SAT和FAT相对应,FAT是在设备制造商处进行的测试,SAT就是在使用者这里进行的测试了。那么SAT和IOQ之间有什么区别和联系呢?说实在的,我的理解是两者之间,差别不大,如果硬要说有差别,SAT的测试范围可能更为广泛,包括一些在安装调试过程中,进行的一些额外的测试。IOQ可能就是只需要确认最后的安装状态就好。个人认为,如果SAT做的详细,IOQ文件完全可以引用SAT,当然,前提条件是,足够详细,能够完全涵盖到IOQ的测试内容。同样,一般SAT的方案,好的设备供应商有较为详细的方案,这个方案是需要使用者审核确认的,使用者也可以根据自己的要求,提出SAT方案。)
IQ(Installation qualification)
安装确认
IQ should provide documented evidence that the installation was complete and satisfactory.
IQ应该提供文件证据证实安装已完成并且是令人满意的。
The design specifications, including purchase specifications, drawings, manuals, spare parts lists and vendor details should be verified during IQ as should the configuration specifications for the intended operational environment.
设计规范,包括采购规范、图纸、说明书,备件清单和供应商详情应该在IQ阶段被核实。预期的操作环境的配置规范也一样。
Components installed should be verified and documented evidence should be provided that components meet specifications, are traceable and are of the appropriate material of construction.
部件安装应该被核实并且应提供文件依据证实部件符合规范要求,可追溯并由适当的材质组成。
Control and measuring devices should be calibrated.
控制和测量装置应该被校准。
OQ(Operational qualification)
运行确认
OQ should provide documented evidence that utilities, systems or equipment and all its components operate in accordance with operational specifications.
OQ应该提供文件证据证实设施、系统或设备以及它的所有部件的运转符合操作说明书。
Tests should be designed to demonstrate satisfactory operation over the normal operating range as well as at the limits of its operating conditions (including worst-case conditions).
测试应该被设计来证实在正常操作范围和操作条件的边界(包括最差条件)下满意的运行。
Operation controls, alarms, switches, displays and other operational components should be tested.
运行控制、报警、开关、显示和其它操作部件应该被测试。
Measurements made in accordance with a statistical approach should be fully described.
应该充分描述按照统计学方法设计的测量。
PQ:Performance qualification
性能确认
P Q should be conducted prior to release of the utilities, systems or equipment under conditions simulating conditions of intended use to provide documented evidence that utilities, systems or equipment and all its components can consistently perform in accordance with the specifications under routine use.
PQ应该在设施、系统或设备放行前执行模拟预期使用的条件来提供文件证据证实设施、系统或设备以及它的所有部件在日常使用下可以一贯地符合标准。
Test results should also be collected over a suitable period of time during continuous process verification and/or periodic review and monitoring of the utilities, systems and equipment to prove consistency.
测试结果还应在连续工艺核实期间和/或周期回顾和监测的适当时期收集来证实一致性。
它们的顺序:
Stages of qualification should normally start with the preparation of user requirement specifications (URS). Depending on the function and operation of the utility, equipment or system, this is followed by, as appropriate, different stages in qualification such as a factory acceptance test (FAT), site acceptance test (SAT), design qualification (DQ), installation qualification (IQ), operational qualification (OQ) and performance qualification (PQ).
通常地,确认应该从用户需求规范(URS)的准备开始。然后根据设施、设备或者系统的功能和操作特点,选择不同的确认阶段,如工厂验收测试(FAT),现场验收测试(SAT),设计确认(DQ)、安装确认(IQ)、运行确认(OQ)和性能确认(PQ)。
One stage of qualification should be successfully completed before the next stage is initiated, e.g. from IQ to OQ.
确认时,一个阶段在开始下一个阶段前被成功地完成,例如,从IQ到OQ。
In some cases, only IQ and OQ may be required, as the correct operation of the equipment, utility or system could be considered to be a sufficient indicator of its performance.
在某些情况下,只需要进行IQ和OQ,设备、设施或系统的正确操作就可以被认为它的性能的一个充分的指标了。
Major equipment and critical utilities and systems, however, may require URS, DQ, IQ, OQ and PQ.
主要设备和关键设施和系统则可能需要URS、DQ、IQ、OQ和PQ。
Computerized systems, including equipment with software component(s), require user and functional requirements specifications, design and configuration specifications, development of SOPs, training programmes for system use and administration, and an appropriate level of IQ, OQ and PQ verification testing. This includes tests such as stress, load, volume and other performance verification tests that mimic the live production environment. It also includes user acceptance testing according to draft SOPs and training as well as end-to-end business processes for intended use.
计算机化系统,包括有软件构件的设备,需要用户和功能需求规范、设计和配置规范,开发SOP,系统使用和管理的培训计划,和一个适当水平的IQ、OQ和PQ测试。这包括测试如压力、负载、容量和其他模拟动态生产环境的性能测试。这也包括根据SOP草案和培训以及对预期使用的业务流程的用户验收测试。
它们的关系:
FAT、SAT没有交叉
FAT、IQ、OQ可能有交叉
IQ和OQ也没有交叉
SAT和IQ/OQ可能有交叉
降低验证成本的方法
确认和验证的范围和程度应根据风险评估的结果确认并不仅仅是一句法规要求,还是一种对验证应科学合理而不是一味浪费做一些无效验证的期望。
例如,具有相同制粒过程,但片重不同的一系列规格的片剂工艺,可以通过风险评估考虑简化的验证程序。而不是对每一个片剂工艺的每一个步骤都分别验证。
例如,采用相同容器规格、材质和灭菌参数,但装量不同的液体装载。可以通过风险评估对最大装量的最大装载和最小装量的最小装载作为代表来进行确认。
这些方法均需在充分风险评估的基础上进行。以下是有关这些方法的法规或指南描述。
EU GMP 附录15
Bracketing approach.
括号法(分组法)
A science and risk based validation approach such that only batches on the extremes of certain predetermined and justified design factors, e.g. strength, batch size and/or pack size, are tested during process validation. The design assumes that validation of any intermediate levels is represented by validation of the extremes. Where a range of strengths is to be validated, bracketing could be applicable if the strengths are identical or very closely related in composition, e.g. for a tablet range made with different compression weights of a similar basic granulation or a capsule range made by filling different plug fill weights of the same basic composition into different size capsule shells. Bracketing can be applied to different container sizes or different fills in the same container closure system.
一种基于风险的科学验证方法,采用该方法进行工艺验证的过程中,只对预定或经过论证的设计因素,例如,剂量、批量和/或包装规格,的极端条件进行测试。该设计假定所有中间水平的验证可以由极端情况的验证来代表。如果要验证的是一个范围的剂量,这些剂量的组成是相同的或相近的,例如,有类似的基本制粒过程,但片重不同的一系列片剂,或具有相同的基本组成,都是采取填充形式装入不同大小的胶囊壳中的胶囊制剂,就可以应用分组法,括号法可以用于不同包装规格或同一容器密闭系统里不同灌装规格。
APIC 原料药清洁验证指南
7.0 分组法(括号法)
The cleaning processes of multiple product use equipment in API facilities are subject to requirements for cleaning validation. The validation effort could be huge. In order to minimize the amount of validation required, a worst case approach for the validation can be used.
原料药工厂中的多产品设备清洁要求进行清洁验证。清洁工作量会比较大。为了减少验证的工作量,可以采用最差情形方法进行验证。
By means of a bracketing procedure the substances are grouped.
采用分组法时,物质按类进行分组。
A worst case rating prwww.58yuanyou.comocedure is used to select the worst case in each group.
然后在每组中采用最差情形分级法选择各组中最差的情况。
Validation of the worst case situation takes place. However, it is of utmost importance that a documented scientific rational for the chosen worst cases exists.
对最差情形进行验证。至关重要的是,选择最差情形的科学合理性要进行记录。
This chapter gives an overview ofoTpgkLF the suggested work to be carried out, the acceptance criteria and the methodology for evaluation of the data. It should be emphasized that this is only an example to give guidance. The equipment, the substances produced and the procedures in place may vary; and this results in other solutions than those given in this example.
本章介绍了所需要进行的工作、可接受标准和数据评估方法。需要强调的是,这只是一个指导性的例子,而实际情况下,设备、生产的物质和清洁程序可能有所不同,则可能需要采用与例中不同的解决方案。
The worst case rating priority will then support a conclusion that the cleaning procedures are effective for all drug substances and other chemicals within the bracket, including those not individually tested.
最差情形分级优先性是用来支持清洁方法对组内所有原料药和化学物均有效的结论的,包括那些并没有进行单独检测的物质。
中国GMP 附录 确认与验证
第二十一条 采用新的生产处方或生产工艺进行首次工艺验证应当涵盖该产品的所有规格。企业可根据风险评估的结果采用简略的方式进行后续的工艺验证,如选取有代表性的产品规格或包装规格、最差工艺条件进行验证,或适当减少验证批次。
PDA TR01 湿热灭菌程序的验证
PDA TR01 湿热灭菌程序的验证:灭菌oTpgkLF程序的设计、开发、确认以及日常控制
5.4 等效灭菌器
两个或多个设计相似的灭菌器(包括它们相关的公用设施),可确立它们运行的等效性,并减少工艺确认试验的工作量。建议采用比较系统、完善的风险管理方法来证明原由网这一做法的合理性。例如,如果含有多个参数难于控制的灭菌工艺(如预真空工艺),与参数易于控制的灭菌工艺相比,确定等效要困难得多。要减少确认试验,可能需监管部门的批准。在开始时,所有灭菌器必须通过确认灭菌器的运行参数以证明灭菌器之间的等效性。
使用相同的灭菌参数、装载结构(如产品、处方、容器规格、灌装体积、胶塞、设备或装载方式)并对灭菌器运行的结果进行比较,可确定灭菌器之间运行的等效性。用以进行等效比较的标准还应该包括关键和重要参数、热分布、热穿透、 F0 范围和微生物的灭活情况。
5.5 分组法
可以将产品处方设计、容器规格、灌装体积、物品或装载分组,以减少确认的工作量。分组法分可为单端分组法(要求鉴别出最差情况)和双端分组法(要求对被灭菌品的结构和配置加以确认)。最差情况的挑战试验需根据科学原理实施,或通过热穿透或生物灭活试验来确定。
5.5.1 典型产品法
可采用典型溶液法( master solution approach) 将处方分组,进行生物指示剂确认。将挑战微生物试验中耐热性最大的产品作为一个典型,来代表耐热性差的各种处方的产品。通常用耐热性测试仪来测定耐热性。关于耐热性的测试详见 3.1.1 节 D 值的测试。
可采用典型溶液法将处方分组,进行物理确认。处方中粘度最大的产品的确认可以涵盖低粘度的产品。
5.5.2 典型容器规格/装量法
如果采取同一个灭菌参数,则可将设计类似、不同规格和装量的液体分为一组。采用该方法时, 用最大装量的最大容器和最小装量的最小容器作为代表来确认中等规格及中等容器的产品。
5.5.3 典型物品法
也可考虑多孔/坚硬装载的代表性问题。即用最难灭菌的物品来代表较易灭菌的物品。例如,相同材料、直径、管壁厚度、 相同的放置方向及包扎的待确认管子,如果长度不同,则可用最长的管子为代表,来确认较短的管子。
5.5.4 典型装载法
多孔/坚硬装载进行分组确认,要求对物品作最长加热时间(因质量大)和/或最小和最大装载条件下空气去除的确认试验。就最小装量而言,在确认时,可能只需要做腔室的最大加热和/或空气去除的挑战性试验。
如需操作的灵活性,而导致装载规格/大小变化时,应确定最小及最大装载。每个灭菌器,至少进行三次连续的生物指示剂合格试验。对没有固定的加热及冷却速率/次数的灭菌程序而言, 最低装量通常需要进行低热量输入的确认试验, 而最大装载则应当进行挑战试验。如果进行风险评估且认为符合要求时,重复试验可以减少。
PDA TR 13 干热灭菌验证
7.3 Process Equivalency
工艺等效性
It may be possible to establish the equivalence of two or more dry-heat batch processes (chambers) or continuous processes (tunnels) that are of similar design (including utilities being supplied). A robust risk analysis process is recommended to make this determination. Analysis includes, but is not limited to, a design and engineering evaluation. Some factors to consider include:
也许有可能建立2种或以上具有相似设计(包括供应系统)的干热批处理式工艺(烘箱) 或连续式工艺(隧道) 的等效性。在决定之前必须进行充分的风险分析。分析包括但不仅限于, 设计和工程评估。以下因素供参考:
• Chamber or tunnel size and configuration
烘箱或隧道的尺寸和结构
• Airflow dynamics
空气动力学
• Temperature come-up and uniformity
升温和均一性
• Conveyor speed
传送带速度
• Temperature equilibration time
温度平衡时间
• Materials of construction
材料构成
Regulatory approval may be required to support a reduction in qualification testing. Initially, all processes must be qualified and meet operating parameter acceptance criteria in order to demonstrate equivalency.
减少确认测试项可能需要经法规许可。 首先, 所有工艺都需确认,并符合运行参数的可接受标准,以证明其等效性。
Operational equivalence can be established by an analysis of all the process data associated with a validated process in the new equipment. Chamber and load profiles should be compared using the same critical process parameters. The specifications, acceptance criteria, and load configuration should be the same as those used in the established sterilization validation process of the existing equipment. Comparable criteria to be demonstrated should include parameters such as:
可以通过对新设备上的已验证工艺获得的所有工艺数据进行分析建立运行等效性。 腔室和装载物性质应采用相同的关键工艺参数进行对比。 质量标准、可接受标准和装载方式应和之前用于建立当前设备经验证的无菌工艺使用的相一致。 需证明的对比标准包括如下参数:
• Load configurations
装载方式
• Temperature distribution
温度分布
• Heat penetration, F value range
热穿透, F值范围
• BI or EI inactivation
BI或EI灭活
• Heat-up and cool-down times of the product/item
产品/物品的升温和冷却时间
A more detailed discussion on process equivalency can be found in ANSI/AAMI/ISO20857, Sterilization of health care products—Dry heat—Requirements for the development, validation and routing control of a sterilization process for medical devices (30).
更多有关工艺等效性的详细论述,参见ANSI/AAMI/ISO20857有关健康产品灭菌——干热——医疗器械产品灭菌过程开发、验证、日常监控的要求( 30) 。






