What is the difference between OOS / OOE / OOT?
OOS/OOE/OOT有什么不同?
The terms OOS, OOE and OOT always emerge in connection with the handling of deviating analysis results. But what are their definitions?
术语OOS、OOE和OOT都是处理分析结果偏差中的概念,那他们的定义是什么呢?
For some time, ECA's Quality Control Working Group has published a SOP on the handling of OOS results and is currently planning the elaboration of a SOP on OOE and OOT. The OOS SOP respectively the draft of the OOT SOP contains the following definitions for the three terms:
ECA的质量控制工作组曾经公布过一份关于处理OOS结果的SOP,目前他们正在计划起草一份关于OOE和OOT的SOP。OOT的SOP草案中包括了对三个术语的以下定义:
Out-of-Specification (OOS) Results 超标结果(OOS)
A result that falls outside established acceptance criteria which have been established in official compendia and/or by company documentation.
结果超出了由官方药典和/或公司文件既定的可接受标准。
Out-of-Expectation (OOE) Results 超期望结果(OOE)
An atypical, aberrant or anomalous result within a series of results obtained over a short period of time is an OOE result. An OOE result is a result that meets specifications, but is outside the expected variability of the analytical procedure.
在一个短时期内得到的一系列结果中的一个非典型、异常结果。一个OOE结果符合质量标准,但超出检验方法所期望的变动范围。
Out of Trend (OOT) Results 超趋势结果(OOT)
A time dependent result which falls outside a prediction interval or fails a statistical process control criterion.
与时间相关的结果,它超出预期的间隔或未能符合统计学控制标准。
A trend is a sequence of temporal procedures, e.g. for the manufacture of different batches of a product. There are two types of原由网 trends:
趋势是一个随时间而变化的序列,例如,不同批次产品的生产。趋势有两种类型:
In one case, no trend is expected, e.g. in production or when analysing process data where everyone expects that they are under statistical control.
一//www.58yuanyou.com种情况,不期望产生一种趋势,例如,在生产过程中或分析过程中,每个人都期望这些数据在统计学控制范围内。
In the other case, a trend is expected. One typical example for that is stability testing where one expects that the content of the API reduces over the storage period, or that the quantity of impurities increases over time.
另一种情况,预期有一种趋势。一个典型的例子是稳定性研究中,会预期原料药的含量随着存贮时间延长而降低,或杂质会随时间延长而增加。
There is a fundamental difference between these two types of OOT results: indeed, in the second situation the dispersion increases over time.
这两类OOT结果之间有根本的差异,事实上,第二种情形下数据的离散度随时间而增加。
The new Chapter 5 of the EU GMP Guide - coming into force on 1st October 2014 - requires that in future certain data have to be recorded so that trends can be recognized and assessed.
在EU GMP指南的第5章中(将于2014年10月1日生效),要求将来对特定的数据进行记录,这样可以发现其趋势并进行评估。
Comprehensive Document about the Handling of OOE and OOT Results
关于OOE和OOT结果处理的综合文件
How are OOE and OOT results in the pharmaceutical industry to be recorded and assessed nowadays? To answer this question, the ECA Quality Control Working Group and representatives from authorities and industry compiled a guidance document about the handling of Out-of-Expectation (OOE) and Out-of-Trend (OOT) results.
现在制药行业中OOE和OOT 结果如何被记录和评估的?为了回答这个问题,ECA质量控制工作小组及官方和行业的代表编了一份关于OOE和OOT结果处理的指南文件。
This 70 page documentcovers the following issues:
这个70页的文件包括以下几方面:
Regulatory references
法规参考文献
Overview of data management in the laboratory and the analytical process
实验室和分析过程数据管理概况
Responsibilities for QC and QA
QC 和QA的职责
Purpose of trend analysis
趋势分析的目的
The concept of control charts
控制图的概念
Detection and handling of OOE results
OOE结果的发现和处理
Statistical process control (SPC) of continuous and discrete data
连续和离散数据的统计过程控制(SPC)
Techniques for the retrospective review of historical data
历史数据回顾技术
Trend analysis in stability testing
稳定性测试中趋势分析
This document also includes seven Annexes; a technical glossary and worked examples to visualize the most important statistical tools and regression methodsfor a proper setting of stability trend limits.
文件还包括7个附录;一个技术术语表和使最重要的统计工具和适当设置稳定性趋势限度的回归方法可视化的工作示例。
All participants of the "ECA Educa原由网tion Courses Handling OOT-Out-of-Trend Results" on 20-21 November 2017 in Vienna will receive a copy of this important guidance document.
所有参加2017年11月20-21日在维也纳举办的ECA的OOT结果处理教育课程的与会人员都将收到这份重要的指南文件的副本。
译者注:目前该综合文件在ECA官网有售(非欧盟地区采购价500欧元)。文件清单如下:
原文来自ECA网站,点击“阅读原文”可以查看网站原文。Rona翻译,Gary校对。
导语
对超标结果(OOX结果)的正确处理逐渐成为检查重点,也是QA、QC、生产和仓管部门需要关注的问题。
那么//www.58yuanyou.com,当不合格结果出现时应怎么办呢?本文将给出详细解答和具体步骤。
对超标结果(OOX结果)进行符合GMP要求和正确的处理展现了员工和公司对GMP的理解和处理实际问题的水平,因此,监管机构的检查越来越倾向将超标结果的处理作为检查重点。
尽管OOX结果给制药公司带来非常棘手的状况,但正确和自信的处理OOX结果可在审计时展现公司的高质量标准。使用结构化方法进行差错分析和数据评估也为提高质量标准提供了非常有价值的信息。
OOX历史和重要事例
在20世纪80年代末,美国食品和药物管理局进行了一次涉及众多仿制药制造商的调查,发现了严重的质量违规行为(包括丢失试验数据和虚假批准文件),这些违规也涉及到了美国食品和药物管理局的官员。在新的监管体系下,FDA采取了严厉的监管措施并引入了认证前检查(PAI)。这项检查的一个优先事项(重点)就是如何处理异常的检验结果(OOS)。
1993年FDA胜诉Barr实验室的司法案件在发展处理OOX理念和指南上起了开创性作用。Wolin法官的判决使重复检测直到获得合格结果的方式终结(尽管这些产品质量低劣)。当调查OOS结果时特别强调调查的方法,应使用科学合理和有效的方法(例如,使用一个彻底的和结构化的差错分析)。此外,必须确定坚实的措施,以最终做出决定是否放行所检测的产品(例如,定义何种情况进行重复分析)。
OOX包括哪些类型?
虽然超标处理最初只涉及不合格检验结果(OOS)处理,由于日益增强的质量意识它随后拓展为包括超预期结果处理(OOE)、超趋势结果处理(OOT)、原由网校准不合格处理和工艺参数不合格处理(OOL)。所有这些考虑的都是尽早发现可能导致不符合质量标准的情况从而防止实际OOS的出现。
OOS处理的指导原则
上述提到的判决只适用于特定的司法案件,但此案例反映了现在最新的科学和技术。此案让FDA在1998年起草和发布了处理OOX结果的指南,该指南最终在2006年生效,现在被世界公认为黄金标准。基于这样的事实,尽管这个话题讨论的是德国医药产品法规和欧盟GMP指南,这里也详细介绍了FDA的指南。值得一提的是,生物分析测试(活体试验、免疫化学分析)和微生物测试不包括在该指南范围内。
除了这项基本指南,超标调查的法规还有1993年7月发布的《药物质量控制实验室检查指南》以及21 CFR211.192(《联邦法规》第61卷,1996年5月)修订版,另一个参照的法规是2013年英国MHRA发布的《不合格检验结果调查》。
当超标时应如何处理才能符合GMP?
业内普遍认为必须通过预先规定的结构化的程序来找出错误的原因,以便确定合适的纠正和预防措施。
当不合格结果出现时,应立刻启动处理流程,首先要做的是强制性的原始数据复查(四眼原则)和强制性的公司内部信息沟通(沟通范围包括直线经理,质量控制和质量保证负责人,授权人等)。
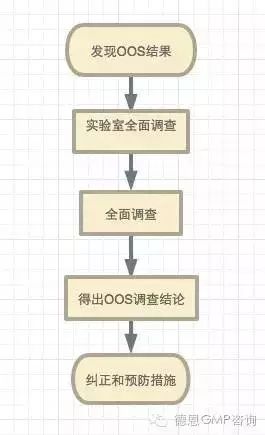
处理流程包括以下步骤:
1. 错误分析
在发现OOS结果并且启动处理流程以后,即开始了花费非常巨大但最重要的阶段——错误分析。错误分析检查通常使用检查表进行,为了找出可能存在的不明显的实验室差错,需进行证实性的检测。
2. 全面调查
如果通过证实性的检测证实了OOS结果,则可以排除实验室差错。在这种情况下必须启动全面调查,这意味着调查范围扩大到包括取样、储存、运输和生产。预先确定OOS调查的协调和实施职责对于调查取得成功至关重要。
如果全面调查没有发现错误,则流程进入下一个阶段,包括重新测试等措施。
3. 重新测试
如果差错分析到全面调查阶段都没有结果,那么初始测试的结果必须被评定为非结论性的,例如,从该结果不能得出检测结论。为了获得测试结论,必须对测试批次的相同样品进行重新测试。重新测试包括至少6份(n=6)独立制备的测试溶液(每份测试溶液包含所有样品制备步骤)。
如有需要,可以使用第二台同种仪器和/或者由另一名分析员来进行重新测试。
得出OOS调查结论和后续措施
OOS调查程序在相关负责人(如QC,QA,QP)批准和签字后正式结束,负责的QP做出拒绝还是放行受影响批次产品的最终决定。
OOS调查程序所得出的结果由QA或其他部门进行归档保存。需保存一个OOS清单,以对OOS产生的原因进行趋势分析或其他评估。分析和评估的结果用于生成关键绩效指标(KPI)并提交管理评审以便解决存在的问题。
如果CAPAs(纠正和预防措施)是某项超标调查的结论,则必须在OOS程序完成之后协调和实施该纠正和预防措施,必须监测纠正和预防措施的实施结果和有效性,这通常由QA在CAPA系统的框架下进行。
在那些情况下可以使用OOX程序?
OOX程序在方法转移、验证和外包服务中也扮演重要的角色。如果能遵守预先定义的职责和文件要求,则OOX程序也可以在第三方介入时很好地实施。所有参与OOX程序的人员都应完成相关的所有培







