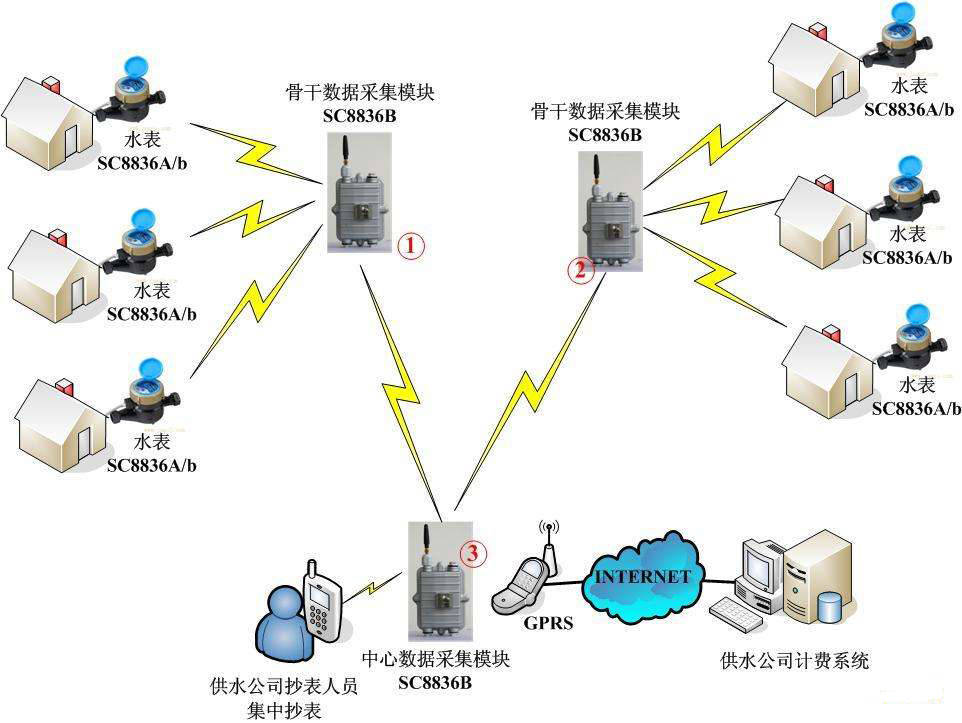
今天给大家准备的知识汇总是有关硫酸和硝酸的知识~希望对你有所帮助~
硫酸和硝酸
【学习目标】
1.以稀硫酸、硝酸为例复习酸的通性;
2.理解浓硫酸的吸水性、脱水性以及氧化性等三大特性;
3.理解硝酸的强氧化性及硫酸和硝酸的用途。
重点:浓硫酸、硝酸的化学性质
难点:浓硫酸和硝酸的氧化性
【知识梳理】

一、稀硫酸
要点诠释:
稀硫酸中存在着电离方程式:H2SO4=2H+ +SO42-,由于硫酸是强电解质,在水中完全电离,所以在稀硫酸中存在的微粒是H+、SO42-和H2O。浓硫酸(质量分数为98%)中,几乎不含水,所以在浓硫酸中几乎不存在硫酸的电离,也就几乎不存在H+和SO42-离子,几乎全以硫酸分子形式存在。所以如果说稀硫酸体现的是H+的性质(只要是酸都能电离出氢离子,所以稀硫酸体现的是酸的通性。),那么浓硫酸则体现出硫酸分子的性质,也就是具有特性。
稀硫酸具有酸的通性:
(1) 指示剂变色:石蕊变红;酚酞不变色。
(2) 与金属反应:Fe+H2SO4==FeSO4+H2↑ ;2Al + H2SO4==Al2(SO4)3+ 3H2↑
(3) 与碱的反应:2NaOH+H2SO4==Na2SO4+2H2O
(4) 与碱性氧化物反应:CuO +H2SO4== CuSO4+H2O
(5) 与某些盐的反应:BaCl2+H2SO4==BaSO4↓+ 2HCl
二、浓硫酸
(一)物理性质
(1)纯硫酸:无色、粘稠的油状液体、难挥发
(2)98%的浓硫酸的密度为1.84g/cm3
(3)沸点高:沸点338℃,高沸点酸能用于制备低沸点酸
(4)硫酸与水任意比例混溶;
浓硫酸的稀释(酸入水):将液体沿器壁或沿玻璃棒慢慢加入水中,并不断搅拌使其混合均匀。
(二)浓硫酸的特性
浓硫酸的特性有:吸水性、脱水性和强氧化性。
要点诠释:
1.吸水性与脱水性的区别
浓硫酸吸水是把物质本身中含有的自由H2O分子或结晶水吸收。浓硫酸脱水是把本身不含水dPIzcWwYX的有机物中的氢元素和氧元素按原子个数比2∶1的形式脱去,
C12H22O11=浓硫酸=12C+11H2O。所以,二者的本质区别是物质中有没有现成的水分子。注意:在浓硫酸作用下,结晶水合物失去结晶水属于浓硫酸的吸水性。
利用浓硫酸的吸水性,常用浓硫酸作干燥剂,浓硫酸可以干燥H2、Cl2、O2、SO2、N2、CO2、CO、CH4等气体,但是它不能用来干燥碱性气体(如NH3)和强还原性气体(如HBr、HI、H2S)。
2.强氧化性:在浓硫酸中主要是以硫酸分子的形式存在,体现的是硫酸分子的性质。在硫酸分子中,存在+6价硫,很容易得电子被还原,所以具有很强的氧化性。浓硫酸能将大多数金属(如Cu)或非金属(如C)氧化:
(1)Fe、Al的钝化
常温下,当Fe、Al等金属遇到浓硫酸时,会与浓硫酸发生反应,表面生成一层致密的氧化物薄膜而出现“钝化”现象。
(2)与不活泼金属和非金属的反应
由于浓硫酸具有强氧化性,故存在与稀硫酸不同的化学性质,能够与不活泼金属或非金属发生反应,反应过程中有如下规律:
①反应要加热,否则不反应;
②还原产物一般是SO2。一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
③浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。如:
Cu+2H2SO4(浓)CuSO4+ 2H2O +SO2↑
2Ag+2H2SO4(浓) Ag2SO4+SO2↑+2H2O
C+2H2SO4(浓) CO2↑+2H2O+2SO2↑
S+2H2SO4(浓) 3SO2↑+2H2O
④浓硫酸氧化含低价非金属元素的化合物
H2S+H2SO4(浓)==S↓+SO2↑+2H2O
或H2S+3H2SO4(浓)4SO2↑+4H2O
2HI+H2SO4(浓)==I2+www.58yuanyou.comSO2↑+2H2O
2HBr+H2SO4(浓)==Br2+SO2↑+2H2O
⑤随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反dPIzcWwYX应就停止。
(三)硫酸的用途
硫酸是重要的化工原料,也是化学实验室必备的重要试剂。在工业上可用来制造化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、干燥剂或制取各种挥发性酸等等。

三、硝酸
(一)硝酸的物理性质
无色,易挥发,具有刺激性气味的液体,易溶于水。浓硝酸常因为溶解有NO2而呈黄色。质量分数为69%的硝酸为常用浓硝酸。98%以上的硝酸称之为发烟硝酸。
(二)硝酸的化学性质
1.硝酸具有酸的通性
①与金属反应:一般不生成氢气
②与碱性氧化物反应:如CuO、Na2O、Fe2O3等
③与碱反应:Cu(OH)2、NaOH等
④与盐反应:NaHCO3、Na2CO3等
⑤与指示剂反应:浓硝酸可使石蕊先变红后褪色
要点诠释:
在利用HNO3的酸性时,要注意考虑它的强氧化性。如FeO与稀硝酸反应时的方程式应是:
3FeO+10HNO3(稀)==3Fe(NO3)3+NO↑+5H2O,而不是FeO+2HNO3(稀)==Fe(NO3)2+H2O。
2.不稳定性: 硝酸是不稳定性酸,受热或者光照易分解,所以实验室中常用棕色瓶储存硝酸。
4HNO3O2↑+ 4NO2↑+ 2H2O
3.硝酸的强氧化性
要点诠释:
由于HNO3中的+5价氮元素有很强的得电子能力,在硝酸参与的氧化还原反应中,几乎全部是+5价氮被还原,故硝酸具有强氧化性。硝酸的强氧化性规律:①温度越高,硝酸越浓,其氧化性越强。 ②与硝酸反应时,还原剂一般被氧化成最高价态。
(1)浓硝酸能使紫色石蕊试液先变红,后褪色。
(2)与非金属单质C、S、P等在加热条件下反应,非金属元素被氧化成酸性氧化物。如:
C+4HNO3(浓) CO2↑+4NO2↑+2H2O,
S+6HNO3(浓) H2SO4+6NO2↑+2H2O。
(3)金属与HNO3反应一般不生成H2,浓HNO3一般被还原为NO2,稀HNO3一般被还原为NO,极稀HNO3可被还原成NH3,生成NH4NO3等。
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
浓硝酸与Cu反应时,若Cu过量,反应开始时浓硝酸的还原产物为NO2,但随着反应的进行,硝酸变稀,其还原产物将为NO,最终应得到NO2与NO的混合气体,可利用氧化还原反应过程中化合价升降总数相等的守恒规律求解有关Cu、HNO3和混合气体之间的量的关系。
(4)钝化:常温原由网时,冷的浓硝酸、浓硫酸可使铝、铁表面生成致密的氧化膜,阻止酸与金属的进一步反应,这种现象叫钝化。钝化其实也是硝酸强氧化性的表现,利用金属Al和Fe的这种性质,我们可以用Al或Fe制www.58yuanyou.com的容器来盛装浓硫酸或浓硝酸。
来源:网络,如侵权,请联系删除。
~